Com o surgimento do SARS-CoV-2 e a pandemia que ele produziu no mundo, a humanidade passou a ansiar por uma vacina e acompanhar diariamente e passo a passo o processo de elaboração desses produtos. Porém, este é um processo que é e precisa ser lento, cuidadoso e rigoroso, para que o produto final tenha a eficiência necessária.
Dezenas de laboratórios de diferentes países do mundo se lançaram no desafio de encontrar uma vacina para a covid-19. A maioria já está trabalhando há meses, e alguns inclusive prometem ter o seu produto lançado ainda neste 2020, outras estipulam o início de 2021 como prazo para finalização dos trabalhos.
Por que as vacinas contra covid-19 estão sendo desenvolvidas tão rapidamente?
O processo para desenvolver uma vacina é crucial para interromper o avanço ou a difusão de uma pandemia. E é preciso segui-lo, sob risco de, no final, algum problema negligenciado vir à tona e prejudicar os que foram vacinados, já que se trata de fazer o corpo humano gerar uma resposta imune que, quando entra em contato com o agente causador da doença, atua para protegê-lo e evitar as consequências da infecção.
Também vale destacar que as vacinas são produtos biológicos, ou seja, são produzidas a partir de organismos vivos, como vírus e bactérias. Sua elaboração requer um protocolo complexo, com vários estágios controlados do início ao fim. Desde a obtenção desses organismos, que são o ponto de partida de um projeto, cada passo deve atender os mais altos níveis de qualidade e segurança.
Fase exploratória
A primeira fase do processo de desenvolvimento da vacina é o de entender a doença, estudar a estrutura biológica do seu agente e seus dados epidemiológicos.
Uma vez isolado o agente infeccioso, trabalha-se em desvendar algumas perguntas: sua origem, a forma pela qual ele persiste na natureza, seu modo de transmissão, suas vias de entrada no organismo humano e de outros seres vivos, quais proteínas ele utiliza para realizar a infecção, que fator ou fatores são responsáveis por seu poder patogênico, entre outras.
Ao se descobrir as proteínas que podem ser usadas para prevenir sua ação (para produzir uma vacina) ou tratar os sintomas que ela causa e eliminar sua presença do organismo humano (para desenvolver um tratamento), se avança à criação de um desses produtos.
No caso de um projeto de vacina, esta fase também tem como o objetivo identificar os genes que são importantes para desencadear no organismo humano uma resposta imune eficaz, e inclusive, se for necessário, até mesmo a sua remodelação genética, para aumentar sua eficiência. Uma vez alcançados esses dados, se avança à fase pré-clínica.
Fase pré-clínica
Nesta fase do processo, o objetivo é estudar a possibilidade de eficácia dos antígenos de interesse, se são capazes de induzir uma resposta imune protetora e se são seguros, ou seja, são bem tolerados pelo organismo humano e não geram efeitos colaterais.
A fase pré-clínica é quando se realizam as provas experimentais em animais, geralmente roedores ou primatas, devido à similitude com o organismo humano.
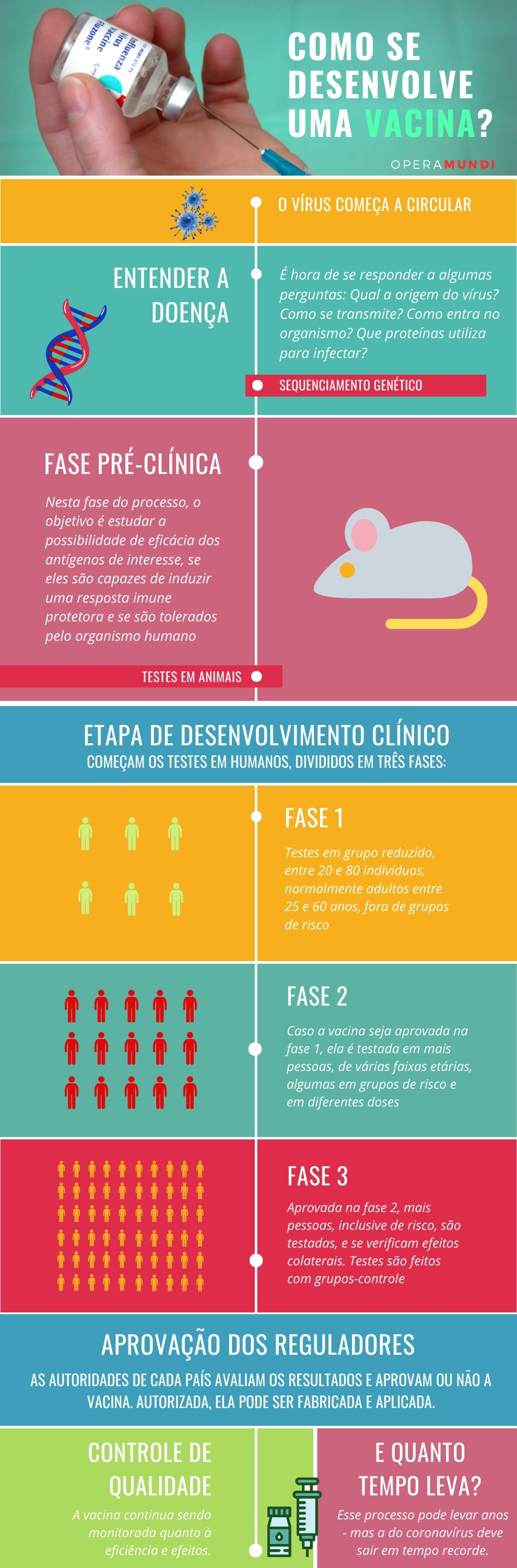
Esses ensaios servem para se ter uma noção das respostas celulares que podem ser esperadas em humanos, e podem sugerir dados como a dose inicial segura para a próxima fase e o método mais seguro de administração da vacina.
Também é a fase em que os pesquisadores podem adaptar o produto através de mutações, para tentar torná-la mais eficaz.
Desenvolvimento clínico
O desenvolvimento clínico é considerado a fase mais importante do processo, já que é quando a vacina é provada em humanos.
Consiste em três etapas, e a primeira delas tem como objetiva fazer a primeira avaliação do produto e seus resultados, razão pela qual é observada em um grupo mais reduzido (entre 20 e 80 indivíduos) e de menor diferença etária (geralmente adultos com mais de 25 e menos de 60 anos).
Mesmo em vacinas destinadas a crianças, se recomenda que esta etapa utilize voluntários adultos, já que o principal objetivo é observar os efeitos do produto de forma geral, incluindo os possíveis efeitos adversos e a dimensão da resposta imune que ele gera.
Na segunda etapa de desenvolvimento clínico, o grupo de pessoas testada aumenta em tamanho (das entre 20 e 80 testadas na etapa anterior, para algumas centenas desta vez) e em diversidade de voluntários, incluindo maior variedade de faixas etárias e pessoas pertencentes a grupos de risco e infectados assintomáticos.
Esses ensaios expandidos devem ser randomizados e bem controlados. Seu objetivo é estudar a segurança e a imunogenicidade (capacidade do sistema imunológico de reagir contra o antígeno), além de verificar detalhes como a quantidade de doses necessárias, um cronograma de imunizações e o método de administração da vacina.
Finalmente, a terceira etapa de desenvolvimento clínico reúne um grupo ainda maior de voluntários, geralmente milhares deles. Novamente, o objetivo é avaliar a segurança da vacina, já que alguns efeitos colaterais podem não ser tão evidentes nas etapas anteriores.
Durante esta etapa, os testes são realizados em um processo aleatório que envolve a aplicação de uma vacina experimental e um placebo usado como comparação – para contrastar os efeitos produzidos entre os voluntários que tomaram a vacina e os que tomaram o placebo.
Regularização e pós-comercialização
Superadas estas três etapas e concluída a fase de desenvolvimento clínico, a etapa seguinte é a de autorização regulatória, que varia de acordo com cada país. O produto é enviado às autoridades sanitárias, que devem submetê-lo ao protocolo de regularização correspondente.
Uma vez autorizada, a vacina pode ser fabricada, distribuída e aplicada. Porém, o processo não acaba aí. Existe também uma fase posterior à da elaboração, conhecida como “pós-comercialização”, ou de “controle de qualidade”, que consiste no monitoramento dos resultados do produto quando este já está sendo utilizado.
Nessa etapa, também se busca observar como a vacina atua diante das possíveis mutações do vírus, e verificar a necessidade de modificar o produto para proteger contra esse novo vírus.












































































